به گزارشحیات، ویروسدرمانی» بهعنوان یکی از نوآورانهترین روشهای درمان سرطان، در سالهای اخیر توجه زیادی را در عرصه پزشکی جهانی به خود جلب کرده است. این روش با استفاده از ویروسهای مهندسیشدهای صورت میگیرد که قادرند به طور اختصاصی سلولهای سرطانی را هدف قرار داده و تخریب کنند، بدون اینکه به سلولهای سالم آسیب برسانند. این ویروس ها که ویروسهای آنکولایتیک نام دارند، نه تنها باعث نابودی مستقیم تومورها میشوند، بلکه با تحریک سیستم ایمنی بدن، موجب افزایش پاسخ دفاعی طبیعی علیه سرطان میگردند.
در کشور ما، پژوهشکده معتمد سرطان وابسته به جهاد دانشگاهی با بهرهگیری از دانش و فناوریهای نوین، به عنوان یکی از مراکز پیشرو در توسعه این روش درمانی فعالیت میکند. این پژوهشکده در حال حاضر در مرحله پیشبالینی و توسعه فرمولاسیون ویروسهای درمانی قرار دارد و همزمان با انجام آزمایشهای آزمایشگاهی، به آمادهسازی زیرساختهای لازم برای ورود به فازهای بالینی میپردازد. این مراحل شامل بهینهسازی ویروسها، ارزیابی اثرات ایمنی و اثربخشی در مدلهای حیوانی و همچنین همکاری با مراکز درمانی برای طراحی مطالعات بالینی است.
به منظور کسب اطلاعات جامعتر و آشنایی با دستاوردها و چالشهای پژوهشکده در مسیر توسعه ویروسدرمانی، گفتگویی با دکتر صرامی فروشانی، رئیس پژوهشکده سرطان معتمد جهاد دانشگاهی و عضو شورای راهبردی شبکه تحقیقات پزشکی مولکولی کشور داشتیم تا جزئیات دقیقتری از روند پیشرفت پروژه و چشماندازهای آتی آن را کسب کنیم.
بخش اول گفتگو با رئیس پژوهشکده سرطان معتمد جهاد دانشگاهی پیشتر در خبرگزاری مهر منتشر شده بود (لینک) و در ادامه، بخش دوم آن در نوشتار زیر قابل مشاهده است؛
*آقای دکتر به عنوان سوال نخست بفرمایید که «ویروس درمانی» در درمان سرطان مشخصا چطور عمل می کند؟ این ویروس ها چطور میتوانند به صورت اختصاصی فقط سلولهای سرطانی را هدف بگیرند و به بافتهای سالم آسیب نرسانند؟
موضوع ویروسدرمانی یکی از جذابترین شاخههای پزشکی نوین است، در روشهای مبتنی بر ویروسهای ناقل، از ویروسهایی استفاده میشود که ساختاری ساده و توخالی دارند. این ویروسها تنها بخشهای حیاتی خود را حفظ میکنند، قادر به تکثیر نیستند و صرفاً ژن درمانیِ مورد نظر را به سلول هدف منتقل میکنند، اما نوع دیگری از ویروسها نیز وجود دارند که به آنها «ویروسهای عملیاتی» یا «فانکشنال» گفته میشود. این ویروسها توانایی تکثیر و حمله به بافتهای هدف، از جمله بافتهای سرطانی را دارند و قادرند آنها را تخریب کنند. این همان مفهوم «ویروسدرمانی با استفاده از ویروسهای آنکولایتیک (Oncolytic Viruses)» است؛ ویروسهایی که میتوانند بهصورت طبیعی یا مهندسیشده دارای این قابلیت باشند.
با این حال، ویروسهای آنکولایتیک طبیعی در بسیاری از موارد قدرت کافی برای درمان کامل بیماری را ندارند. از همین رو، روند فناوریهای نوین بهسمت توسعه ویروسهای آنکولایتیک مهندسیشده حرکت کرده است. در این روش با دستکاری ژنتیکی ویروسها، آنها را طوری طراحی میکنیم که بهصورت هدفمند و اختصاصی، تنها به سلولهای سرطانی حمله کنند، در بافتهای سالم غیرفعال باشند، آسیبی به بافتهای طبیعی وارد نکنند، عملکردی قابلکنترل و ایمن داشته باشند و در تخریب بافت هدف، اثربخشی بالایی از خود نشان دهند. مجموعه این ویژگیها موجب شده ویروسهای آنکولایتیک مهندسیشده بهعنوان یکی از ابزارهای نوین درمان سرطان، در صدر پژوهشهای علمی و بالینی جهان قرار بگیرند.
*پیش از این هم در یکی از سخنرانی هایتان اعلام کرده بودید که توسعه ویروسهای درمانی سرطان یکی از پیچیدهترین پروژههای مهندسی ویروس محسوب میشود. اساسا این پیچیدگی به چه علت یا علت هایی است؟
این فناوری جدید نیست و تاریخچه و سابقهای چند دههای دارد.
فرآیند ویروسدرمانی از پیچیدگیهای بالایی برخوردار است. با اینکه تاکنون صدها کارآزمایی بالینی با انواع مختلفی از ویروسها انجام شده، تنها سه کشور—ایالات متحده، ژاپن و چین—موفق به تولید و عرضه سه محصول مبتنی بر این فناوری به بازار جهانی شدهاند. این واقعیت، خود گویای دشواریهای متعدد و ابعاد پیچیدهی این فناوری در مراحل مختلف توسعه، طراحی، تولید و تجاریسازی است.
اولین مرحله در این فرایند پیچیده، دستکاری ژنتیکی ویروسهاست. از آنجا که ژنوم اکثر ویروسها بسیار کوچک و فشرده است، حتی تغییرات جزئی ممکن است عملکرد یا ساختار آنها را بهطور کامل مختل کند. در مقابل، ویروسهایی با ساختار ژنتیکی بزرگتر نیز چالشهای خاص خود را دارند و دستکاری آنها بسیار دشوارتر است. مرحله دوم، تولید انبوه ویروسهای مهندسیشده است. پس از مهندسی ژنتیکی، لازم است ویروسها در مقیاس بالا و صنعتی تکثیر شوند—فرآیندی که یکی از چالشبرانگیزترین مراحل در زنجیره تولید ویروسدرمانی به شمار میرود.
در سومین مرحله، ویروسهای تولیدشده باید خالصسازی شوند؛ به این معنا که تمامی ناخالصیها، از جمله سلولهای میزبان یا اجزای جانبی فرایند تولید حذف گردند، در حالی که ویژگیهای درمانی و عملکرد مؤثر ویروس همچنان حفظ شود. این تعادل بین پاکسازی کامل و حفظ اثربخشی، کاری بسیار ظریف و فنی است. پس از گذر از مراحل طراحی، تولید و خالصسازی، گام بعدی ارزیابی ایمنی، سلامت و اثربخشی ویروسهای طراحیشده است. این ارزیابی ابتدا در مدلهای آزمایشگاهی و سپس در مدلهای حیوانی انجام میشود— مجموعهای از مطالعات که با عنوان «مطالعات پیشبالینی» شناخته میشوند. در صورتی که نتایج این مطالعات رضایتبخش باشد، وارد مراحل بعدی یعنی کارآزماییهای بالینی انسانی در فازهای مختلف میشویم.
*سؤال مهم این است که جایگاه ایران در مسیر توسعه ویروس درمانی سرطان کجاست و پژوهشکده معتمد سرطان تا چه اندازه توانسته است این پروژه را راهبری و پیش ببرد؟
من چندین سال از عمرم را در خارج از کشور، در معتبرترین مراکز تحقیقاتی آمریکای شمالی و اروپا گذراندم و با برجستهترین دانشمندان این حوزه همکاری مستقیم داشتم. با اینکه بیان این موضوع شاید شبیه خود انتقادی بهنظر برسد، اما حقیقت آن است که از لحاظ سطح علمی، دانشمندان و “رسوب دانش”، در کشور چیزی کم نداریم. شخصاً چندین پژوهشگر برجسته را میشناسم که بهطور مستقیم روی این پروژهها کار کردهاند.
ما در جهاد دانشگاهی این پروژه را حدود سه تا چهار سال پیش آغاز کردیم و تنها به تکیه بر دانش فنی اکتفا نکردیم. دو عامل کلیدی نقش بسزایی در موفقیت و شتاببخشی به مسیر پروژه داشتند. اول، تفکر جهادی بود—مفهومی که برای ما صرفاً یک شعار نیست. گرچه ممکن است برخی واژهها بر اثر تکرار، از معنا تهی شوند، اما در اینجا تفکر جهادی به معنای واقعی کلمه بهکار گرفته شد: پایبندی به یک هدف متعالی، حتی به قیمت صرفنظر کردن از منافع شخصی. عامل دوم، اعتماد به نخبگان جوان کشور بود. با تکیه بر تخصص این جوانان و فراهمسازی حداقل زیرساختهای لازم، توانستیم مسیر توسعه را با شتاب طی کنیم.
در حال حاضر موفق به انجام مهندسی سازه ویروسی به منظور تولید یک «آدنوویروس انکولیتیک» در کشور شدهایم، فرایند تولید ویروس را پشت سر گذاشتهایم، تستهای آزمایشگاهی و مطالعات حیوانی (پیشبالینی) را با موفقیت به پایان رساندهایم و وارد فاز یک کارآزمایی بالینی انسانی شدهایم
در حال حاضر، موفق به انجام مهندسی سازه ویروسی به منظور تولید یک «آدنوویروس انکولیتیک» در کشور شدهایم، فرایند تولید ویروس را پشت سر گذاشتهایم، تستهای آزمایشگاهی و مطالعات حیوانی (پیشبالینی) را با موفقیت به پایان رساندهایم و وارد فاز یک کارآزمایی بالینی انسانی شدهایم. در این مرحله، ویروس توسعه داده شده را به بدن داوطلبان تزریق میکنیم—رویدادی که بدون شک، یک افتخار ملی محسوب میشود.
در این مرحله، ۲۰ داوطلب در فاز یک بالینی حضور دارند. برای هر فرد، پنج تزریق برنامهریزی شده که بهصورت تدریجی (sclating) از دوز پایین آغاز میشود و در هر مرحله، دوز ده برابر افزایش مییابد. در نهایت، دوز نهایی معادل ۱۰¹² ذره ویروسی است که بهصورت «اینتراتومورال IT» یا تزریق مستقیم به بافت تومور انجام میشود. تاکنون، حدود ۵۰ تزریق با موفقیت انجام شده است.
در اینجا لازم است به یک نکته کلیدی اشاره کنم. مهندسی سازه ویروسی، فرآیندی بسیار پیچیده و تخصصی است. آنچه پروژه ما را متمایز میکند، روشی است که برای طراحی و ساخت ویروس بهکار گرفته شد. در کشورهای پیشرفته معمولاً از ویروسهایی با ژنوم کامل بهعنوان وکتور استفاده میشود اما ما به دلیل نبود آن نمونه، از یک وکتور تجاری کمارزش استفاده کردیم و قطعات ژنتیکی مورد نظر را بهصورت سنتز شده به آن اضافه کردیم.
برای درک بهتر این دستاورد، تصور کنید انسانی را که اعضای حیاتیاش (قلب، کبد، کلیه و …) به دستگاههایی متصل شده تا زنده بماند. حال، اگر بخواهیم این اعضا را بهصورت مصنوعی بازسازی و در بدن پیوند بزنیم، با فرآیندی بسیار پیچیده مواجه خواهیم بود. ما در پروژه خود، کاری حتی دشوارتر انجام دادیم—ساخت ویروسی کاملاً تکثیرپذیرنده و مهندسیشده، بدون دسترسی به نمونه مرجع. این دستاورد، یکی از متمایزترین و پیچیدهترین پروژههای مهندسی ژنتیکی در کشور به شمار میرود.
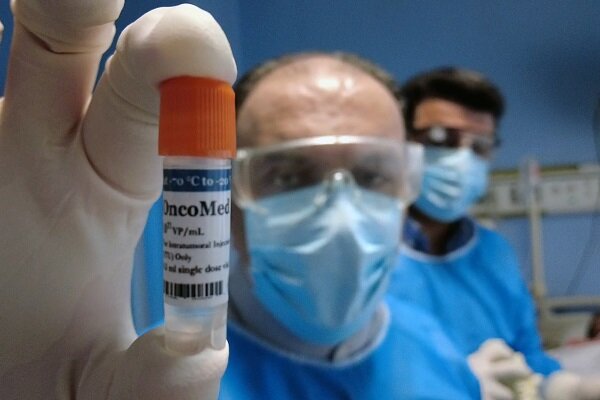
*فرایند تزریق در ویروس درمانی به چه صورت انجام می شود؟ چه مدت زمان می برد تا اثربخشی درمان خودش را نشان دهد؟
تیم مجری کارآزمایی بالینی بهصورت کامل از تیم تولید ویروس تفکیک شده است تا هیچگونه تعارض منافع احتمالی در روند ارزیابی و تحلیل نتایج به وجود نیاید. مطابق با پروپوزال مصوب کمیته اخلاق، پس از انجام کارآزمایی بالینی فاز یک نخستین تزریق، سه تزریق متوالی در سه روز پیاپی انجام میشود. چنانچه وضعیت بالینی فرد مناسب باشد، دو تزریق نهایی با فاصله یک هفته از یکدیگر انجام میگیرد. در مجموع، فرآیند درمان در بازهای بین یک تا سه هفته تکمیل میشود. دوز تزریقها بهصورت افزایشی و طبق الگوی لگاریتمی پایه ۱۰ تنظیم شده است، بهطوریکه هر مرحله نسبت به قبلی، دوزی ۱۰ برابر بیشتر دریافت میکند.
در اینجا لازم میدانم به نکتهای کلیدی اشاره کنم که پیشتر بیان نشد و آن اینکه یکی از ویژگیهای بسیار مهم ویروسهای آنکولایتیک این است که علاوه بر تخریب مستقیم بافت توموری، نقش بسیار مهمی در تحریک سیستم ایمنی ایفا میکنند. در بسیاری از سرطانها با مفهوم «بافت توموری سرد» مواجه هستیم، به این معنا که سلولهای سرطانی موفق میشوند خود را از دید سیستم ایمنی پنهان کرده و عملاً پاسخ ایمنی علیه آنها فعال نمیشود. ویروسدرمانی این معادله را برهم میزند؛ با تحریک سیستم ایمنی و ایجاد محیط «گرم» در بافت توموری، شرایط را برای تخریب سلولهای سرطانی فراهم میکند.
دلیل اشاره به این نکته آن است که گرچه کاهش اندازه تومور ممکن است با تأخیر مشاهده شود، اما آثار تحریک سیستم ایمنی اغلب از همان روزهای ابتدایی تزریق قابل ردیابی است. در پاسخ به پرسش شما درباره زمان مشاهده اثرات درمانی باید تأکید کنم که در فاز نخست کارآزمایی بالینی، مجوزی برای اظهارنظر درباره اثربخشی وجود ندارد و این موضوع منوط به تحلیل نهایی دادهها در مراحل بعدی است. با این حال، میتوان گفت که علائم فعالسازی سیستم ایمنی معمولاً از روز نخست پس از تزریق آغاز شده و آثار آن در فاصله دو تا سه هفته بعد بهوضوح قابل مشاهده است.
*آیا سیستم ایمنی بیماران مانعی برای اثربخشی ویروسها ایجاد میکند؟
نقش سیستم ایمنی در فرآیند ویروسدرمانی دوگانه است و میتواند هم تسهیلکننده و هم بازدارنده باشد. به عنوان مثال، ویروس آدنو، که یکی از رایجترین ویروسهای انسانی است و میتواند عامل طیف وسیعی از بیماریهای خفیف (مانند عفونتهای تنفسی، چشمی و گوارشی) باشد، در بسیاری موارد توسط سیستم ایمنی به شدت شناسایی و مهار میشود. این واکنش سریع ایمنی، یکی از چالشهای اساسی در استفاده از آدنوویروسها بهعنوان حامل (وکتور) در ویروسدرمانی است. پاسخ ذاتی سیستم ایمنی در مواجهه با ورود ویروس، معمولاً بسیار سریع و تهاجمی است و میتواند بلافاصله منجر به حذف ویروس شود.
هنگام ورود ویروس به بدن، سیستم ایمنی ممکن است بهعنوان مانع عمل کرده و با حذف سریع ویروس، از رسیدن آن به هدف درمانی جلوگیری کند. برای کاهش این مداخله ایمنی، راهکارهایی بهکار میبریم؛ یکی از مؤثرترین آنها، تزریق مستقیم ویروس به درون تومور است، بهجای تزریق سیستماتیک از طریق خوندر نتیجه، هنگام ورود ویروس به بدن، سیستم ایمنی ممکن است بهعنوان مانع عمل کرده و با حذف سریع ویروس، از رسیدن آن به هدف درمانی جلوگیری کند. برای کاهش این مداخله ایمنی، راهکارهایی بهکار میبریم؛ یکی از مؤثرترین آنها، تزریق مستقیم ویروس به درون تومور (intratumoral injection) است، بهجای تزریق سیستماتیک از طریق خون. این روش باعث میشود ویروس با کمترین تماس با سیستم ایمنی به سلولهای هدف برسد، از رقیق شدن در پلاسما جلوگیری شود و احتمال حذف سریع آن کاهش یابد.
اما نقش مثبت سیستم ایمنی زمانی بروز میکند که ویروس پس از ورود به بافت توموری، باعث تحریک محیط میکروتومور شده و با آزادسازی آنتیژنها و سیگنالهای التهابی، سلولهای ایمنی را به محل درگیری جذب میکند. در این مرحله، ویروسها علاوه بر تخریب مستقیم سلولهای سرطانی ، با تحریک پاسخ ایمنی، منجر به تخریب غیرمستقیم و تقویت پاسخ ضدتوموری میشوند.بهطور خلاصه، زمانی که پاسخ ایمنی منجر به حذف زودهنگام ویروس میشود، نقش بازدارنده و منفی دارد. اما زمانی که سیستم ایمنی سلولی و ایمنی هومورال (پادتنها) علیه سلولهای سرطانی فعال شوند، تأثیر آن مثبت و تقویتکننده مسیر درمان خواهد بود.
*چگونه مطمئن میشوید ویروس، سلولهای سالم را آلوده نمیکند؟
در علوم پزشکی، هیچ مداخلهای با قطعیت صددرصد همراه نیست. حتی داروهایی که سالها در بازار حضور داشتهاند و ایمن تلقی میشدند، ممکن است در مطالعات فاز چهارم (post-marketing surveillance) عوارض جدیدی نشان دهند که منجر به محدود شدن مصرف یا حتی خروج آنها از بازار شود. در همین راستا، پیش از ورود به فاز انسانی، مطالعات گستردهای در دو سطح انجام دادهایم: هم در شرایط برونتنی با استفاده از کشت سلولی، و هم در مدلهای زنده حیوانی که ویروس بهصورت کنترلشده و هدفمند تزریق شده است.
نتایج این مطالعات نشان میدهد که ویروس طراحیشده، پس از انجام عملکرد درمانی خود، طی بازه زمانی مشخصی بهطور کامل از بدن پاکسازی میشود و تجمع یا ماندگاری بلندمدت ندارد. از نظر عملکرد بیولوژیکی نیز، ویروس آنکولایتیک بهگونهای طراحی شده که تنها در سلولهای توموری تکثیر میشود. بنابراین، پس از تخریب بافت سرطانی، بستر تکثیر برای آن از بین میرود و عملاً امکان گسترش بیشتر نخواهد داشت. علاوه بر این، در مطالعات پیشبالینی، مدت زمان بقای ویروس در بدن بهدقت اندازهگیری شده و از روشهای پیشرفته مولکولی مانند PCR با حساسیت بالا برای ردیابی حتی مقادیر بسیار ناچیز از ویروس در نمونههای زیستی استفاده شده است.
*آیا در این پروژه همکاریهای بینالمللی هم دارید یا تمام مراحل را به صورت مستقل انجام میدهید؟
با توجه به ماهیت راهبردی و حساس این پروژه، همچنین محدودیتهای ناشی از مسائل سیاسی و تحریمهای فناورانه، امکان برقراری همکاریهای بینالمللی در این حوزه بهطور جدی محدود شده است. به همین دلیل، تمامی فعالیتهای تحقیقاتی و توسعهای عمدتاً بهصورت مستقل و درونکشوری توسط تیمهای تخصصی داخلی انجام میشود. با این وجود، مطالعات بینالمللی، مستندات علمی، مقالات معتبر و دادههای کارآزماییهای جهانی بهدقت رصد شده و در فرآیند طراحی، تولید و ارزیابی، بهصورت تطبیقی مورد استفاده قرار گرفتهاند. هدف ما این است که توسعه این فناوری بومی، با استانداردها و شاخصهای بینالمللی در حوزه ایمنی، کارایی و اثربخشی کاملاً همراستا باشد.
*با توجه به ظرفیتهای علمی و فناورانه موجود در کشور و روند پیشرفت پروژههای ویروسدرمانی، مهمترین موانع و چالشهای پیشروی تبدیل این فناوری به یک درمان استاندارد در ایران از نظر شما کدامند؟ نقش نهادهای نظارتی و سیاستگذاران در تسریع روند بالینی و تجاریسازی این فناوری چگونه باید تعریف شود؟
در پاسخ به این پرسش باید گفت که فرایند توسعه این فناوری هماکنون در کشور در حال اجراست؛ با این حال، چالش اصلی، زمان دستیابی به مرحلهای است که بتوان این محصول را در قالب یک داروی استاندارد، رسمی و قابلتوزیع در نظام سلامت عرضه کرد. در حال حاضر، دانش فنی مورد نیاز بهطور کامل در داخل کشور وجود دارد و فناوری نیز به سطح اجرایی رسیده است. حتی از مراکز دیگر نیز درخواستهایی برای تولید و خالصسازی ویروس جهت پروژههای مشابه دریافت کردهایم. دانش پیشبالینی، پروتکلهای درمانی، و تجربیات بالینی نیز با همکاری متخصصان برجسته این حوزه تدوین شدهاند. بنابراین، تأکید میکنم که از نظر دانش تخصصی و توان فنی، هیچ مانع جدی وجود ندارد.
ادامه مسیر، به حمایت هدفمند و هماهنگ نهادهای نظارتی و تصمیمساز بستگی دارد؛ از جمله وزارت بهداشت، معاونت علمی و فناوری، و سایر نهادهای دولتی که در توسعه فناوریهای نوآورانه نقش دارند. این پشتیبانی برای عبور موفق از مراحل کارآزمایی بالینی و رسیدن به بلوغ نهایی فناوری حیاتی است. تحقق تجاریسازی این فناوری، مستلزم حمایت همهجانبه و منسجم از سوی نهادهای کلیدی کشور است تا امکان ارائه آن بهعنوان یک داروی مؤثر و مطمئن برای بیماران فراهم شود. با توجه به اهمیت رعایت سلامت بیماران، نهادهای نظارتی، رویکردی بسیار دقیق و سختگیرانه در این حوزه دارند. با این حال، برای پیشروی به فازهای بعدی به زیرساختهای صنعتی استاندارد نیاز داریم که متأسفانه هماکنون بهطور کامل در کشور فراهم نیست؛ بهویژه زیرساختهای مرتبط با تولید ویروس در مقیاس بالا و مطابق با الزامات کیفی مورد تأیید نهادهای بینالمللی.
تعدد نهادهای تصمیمگیر در سطح سیاستگذاری و تخصیص منابع، موجب پراکندگی وظایف و عدم تمرکز در مسیر توسعه شده است. از سوی دیگر، بودجههای محدود در میان چند نهاد تقسیم میشود، که این موضوع در نبود زیرساخت مناسب، موجب اتلاف منابع و کندی فرآیند میشود. در جمعبندی، مسیر تجاریسازی و بلوغ این فناوری با چالشهایی نظیر نظارت سختگیرانه (اگرچه ضروری)، نبود چارچوبهای قانونی مشخص برای درمانهای نوین، ضعف زیرساختهای صنعتی، پراکندگی در تصمیمگیری، و کمبود منابع مالی مواجه است. علاوه بر چالشهای حاکمیتی، ضعف مشارکت بخش خصوصی و محدودیت منابع دولتی نیز موجب شدهاند روند توسعه این فناوری راهبردی با سرعت مطلوب پیش نرود.

* سوالم را یکبار دیگر و مشخص تر مطرح می کنم، با لحاظ تمامی مواردی که مطرح کردید برای تبدیل این فناوری (ویروس درمانی) به یک داروی رسمی و قابل ارائه به بیماران، چه مدت زمانی لازم است؟
با تفکر دانشگاهی و دولتی ۱۰۰ سال، با تفکر جهادی ان شالله ۵ سال.
*مهمترین چالشهای مهندسی این ویروسها در ایران چیست؟
در حوزه فنی نیز با چالشهای متعددی مواجه هستیم؛ از جمله مهندسی ویروس، طراحی سازه ویروسی، تولید، خالصسازی و تحویل هدفمند. اجرای صحیح این فرآیندها مستلزم وجود تیمی کاملاً متخصص و هماهنگ است که بتواند تمامی مراحل زنجیره تولید، از فرآیندهای بالادستی تا فعالیتهای پایین دستی را با دقت و استاندارد بالا مدیریت کند. یکی دیگر از چالشهای جدی، تأمین مواد اولیه و تجهیزات تخصصی است. بهواسطه تحریمهای بینالمللی، بسیاری از مواد اولیه را با هزینهای چند برابر و تحت شرایط سخت تأمین میکنیم. تجهیزات نیز اغلب با روشهای غیرمستقیم و دور زدن محدودیتها وارد میشوند که این امر عملاً دسترسی به خدمات پشتیبانی و گارانتی را غیرممکن میسازد. این عوامل هزینهها را افزایش داده و ریسکپذیری پروژه را بالا میبرد.
در نتیجه این محدودیتها، ناچار به اتخاذ رویکرد خوداتکایی شدهایم؛ رویکردی که اگرچه نشان از توانمندی داخلی دارد، اما مسیر کار را پیچیدهتر، هزینهبرتر و زمانبرتر کرده است. اما عزم ما برای خدمت در حوزه سلامت راسخ و استوار است.
*ویروسدرمانی روی کدام نوع سرطانها اثرگذار است ...
این پروژه در چارچوبی کاملاً علمی طراحی و تدوین شده و پس از ارائه به کمیته اخلاق، با سختگیری و دقت بالا مورد بازبینی قرار گرفت. تمامی اصلاحات، توصیهها و دستورالعملهای ابلاغشده از سوی کمیته، بهطور کامل اجرا شده است. در ادامه، مطالعه در سامانه رسمی کارآزماییهای بالینی وزارت بهداشت ثبت شد و پس از اخذ مجوز نهایی، روند اجرایی آن آغاز شد. بنابراین میتوان با اطمینان گفت که تمامی مراحل این پروژه در بستری کنترلشده، نظاممند و مبتنی بر اصول علمی و اخلاقی پیش رفته است.
برای دستیابی به دیدی جامعتر از عملکرد این ویروس درمانی و بررسی اثربی خطر بودن(ایمنی) آن در بسترهای مختلف، تصمیم گرفتیم کارآزمایی را به یک نوع خاص از سرطان محدود نکنیم. در عوض، با تعیین شاخصهای دقیق برای ورود و خروج بیماران، سعی کردیم انتخاب نمونهها (کیسها) با بیشترین دقت و کارآمدی انجام شود. بر این اساس، در حال حاضر طیف متنوعی از بیماران با سرطانهای مختلف نظیر سرطان پستان، کبد، ریه، ملانوم (پوستی) و سایر انواع بدخیمیها در این کارآزمایی مشارکت دارند.
*آقای دکتر، سوال پایانی من این است که با توجه به محدودیتهای بودجهای، چگونه منابع مالی پروژه ویروسدرمانی تأمین شده و این منابع چه تأثیری بر روند پیشرفت پروژه داشتهاند؟
اگر بخواهم به برخی منابع کلیدی و حمایتهای اصلی این پروژه اشاره کنم، باید ابتدا به حمایت بنیادین مجلس شورای اسلامی و بهویژه کمیسیون آموزش اشاره کنم. در سالهای گذشته، در زمانی که بودجه کلی پژوهشکده تنها حدود ۴ میلیارد تومان بود، همین میزان بودجه مجدداً از سوی مجلس برای توسعه فناوریهای نوین تخصیص داده شد. این کمک، نقش یک موتور محرکه حیاتی را در توسعه زیرساختهای آزمایشگاهی ایفا کرد. گرچه این بودجه مستقیماً به پروژه ویروسدرمانی اختصاص نداشت، اما بسترهای فنی و آزمایشگاهی لازم را برای اجرای چنین پروژهای فراهم ساخت.
در خصوص منابع تأمین مالی مستقیم پروژه ویروسدرمانی، دو نهاد اصلی نقشآفرین بودهاند. نخست، جهاد دانشگاهی که بهعنوان یک نهاد علمی مستقل و خودگردان فعالیت میکند و تنها حدود ۲۰ تا ۳۰ درصد از بودجه آن از منابع دولتی تأمین میشود. این نهاد با نگاهی بلندمدت و حمایتی، پشتیبان کلیدی پروژه ما بود. دوم، «بنیاد علم» که حمایتهای مالی مؤثری ارائه کرد. لازم به ذکر است که پروژه ویروسدرمانی توانست یکی از معدود پروژههایی باشد که موفق به جذب حدود ۳۰ میلیارد ریال کمک مالی شود؛ حمایتی که نقش تعیینکنندهای در پیشبرد مراحل مختلف این پروژه ایفا کرد.







نظر شما